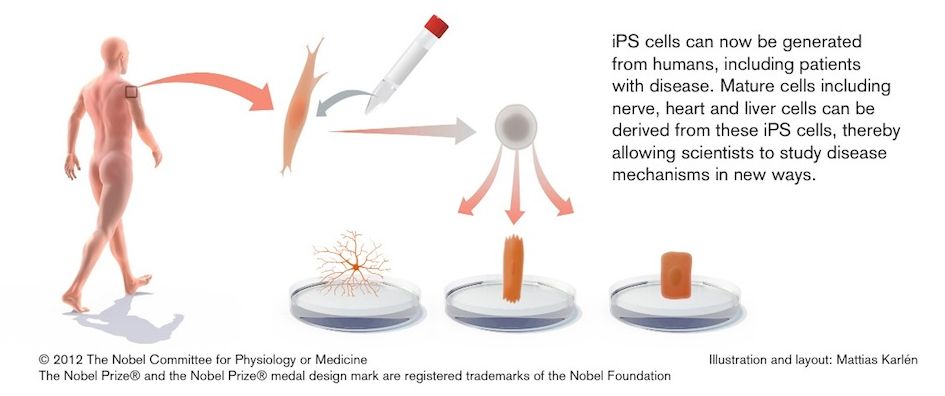
Nel 2012 il premio Nobel per la medicina è stato assegnato a John Gurdon e Shinya Yamanaka per il loro lavoro sulla riprogrammazione cellulare e le
cellule staminali ottenute
a partire da cellule adulte differenziate. Si tratta di una di quelle scoperte che deriva da decenni di studi di base sul differenziamento cellulare e
dall'utilizzo delle moderne biotecnologie. E' una scoperta che rivoluzionerà la medicina e l'approfondimento di questo argomento lo dedico a Elisabetta Rossi,
che fa domande interessanti su malattie "strane"!
Sapete già che negli organismi pluricellulari, le cellule si differenziano e si specializzano in modo da assolvere funzioni diverse nei diversi tessuti. Tutte
le cellule del nostro organismo derivano però da una sola cellula totipotente, in grado cioè di originare tutte le altre, lo zigote. Sapete anche che cellule
come lo zigote sono cellule staminali. Il differenziamento cellulare
e lo sviluppo di un organismo pluricellulare a partire da un'unica cellula sono argomenti complessi, che per decenni hanno arrovellato le menti degli scienziati.
Per diverse generazioni di ricercatori, una domanda cruciale è stata la seguente: "E' possibile riprogrammare una cellula, riportandola ad uno stato totipotente e
indirizzandola poi verso una differenziazione diversa da quella di partenza?"
Era chiaro da tempo che chi avesse risposto alla domanda avrebbe vinto il Nobel! La ragione la capiremo tra breve.
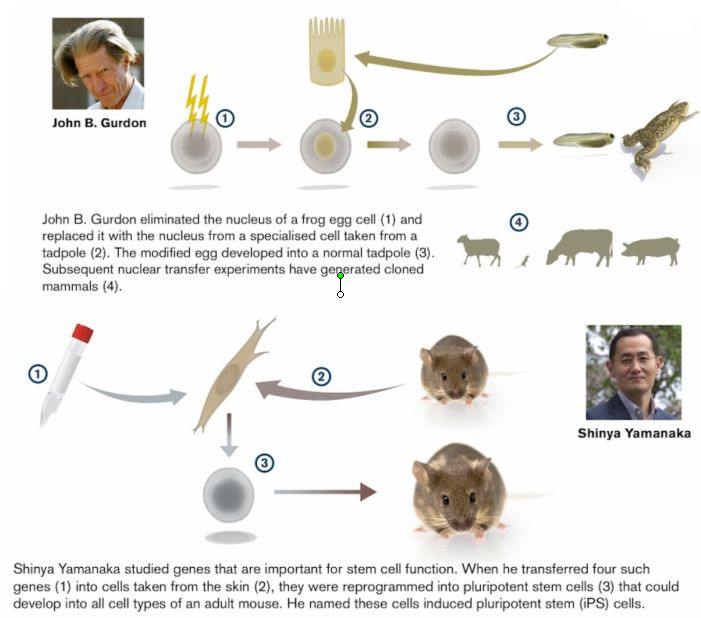 |
John Gurdon negli anni sessanta rimosse il nucleo di un cellula uovo di rana e vi introdusse quello di una cellula differenziata di girino,
ottenendo proprio un girino. Esperimenti successivi di trasferimento nucleare hanno permesso il clonaggio di mammiferi.
Shinya Yamanaka nel 2006 ha studiato i geni che sono indispensabili per il funzionamento delle cellule staminali.
Ha isolato 4 geni, li ha introdotti in cellule già differenziate e queste si sono trasformate in cellule staminali.
(http://www.aalatimes.com/wp-content/uploads/2012/10/Nobel-Prize-in-Medicine-2012.jpg).
|
Gli esperimenti pionieri di John Gurdon risalgono agli anni sessanta del secolo scorso. Egli per primo scoprì e dimostrò che la specializzazione delle cellule è
un processo reversibile, le cellule sono plastiche, cioè la differenziazione non dipende da perdida di cromosomi o fenomeni simili e le
cellule differenziate hanno le stesse informazioni genetiche di quelle staminali, per cui possono essere riprogrammate.
Infatti, rimuovendo il nucleo di una cellula uovo di rana e sostituendolo con quello di una cellula intestinale di girino, Gurdon era riuscito
non solo a riportare la cellula adulta al suo stadio embrionale, ma, addirittura, aveva ottenuto un girino completamente formato. Dopo decenni di studi ora sappiamo che una
cellula adulta può essere riprogrammata, alterando l'ambiente in cui si trova il suo nucleo. Cosa significa? Lo stato di differenziazione cellulare è controllato
da un meccanismo dinamico, che può essere perturbato. Ogni cellula ha lo stesso DNA, ma, grazie alla regolazione genica, non tutti i geni vengono espressi
in ogni cellula e,
soprattutto, geni diversi sono espressi, cioè funzionano, in cellule diverse. Tutto ciò avviene, per esempio, mediante un diverso
stato di metilazione del DNA o l'espressione di diversi fattori di trascrizione all'interno delle cellule. La metilazione infatti non è altro che una modifica
della molecola del DNA e funziona come una specie di etichettatura, tale da differenziare i geni da trascrivere, e quindi esprimere, da
quelli che devono rimanere silenti. Se si riesce a variare questa etichettatura e/o si introducono nella cellula i "giusti" fattori di trascrizione, cioè quelle proteine
che permettono ad un gene di essere espresso oppure no, una cellula può essere riprogrammata ad uno stadio di pluripotenza.
Esitono tre approcci sperimentali che possono riprogrammare una cellula adulta: 1) il trasferimento nucleare, 2) la fusione cellulare e 3) il trasferimento di
fattori di trascrizione.
Nel caso del trasferimento nucleare, il nucleo di una cellula somatica diploide (2n) è trapiantato in una cellula uovo a cui è stato precedentemente tolto il nucleo.
L'ambiente citoplasmatico della cellula uovo riprogramma il nucleo della cellula somatica e si origina così una cellula staminale pluripotente, che genera una
blastocisti da cui poter ricavare cellule staminali embrionali totipotenti (ES cells, embryonic stem cells).
Con questo approccio si possono clonare organismi interi. Ed è così che nel 1997 è stato clonato il primo mammifero, la
pecora Dolly. Nel caso della fusione nucleare, due cellule diverse vengono fuse. Fondendo una cellula differenziata adulta con una staminale embrionale si possono
ottenere, per esempio, nuove cellule staminali oppure cellule differenziate.
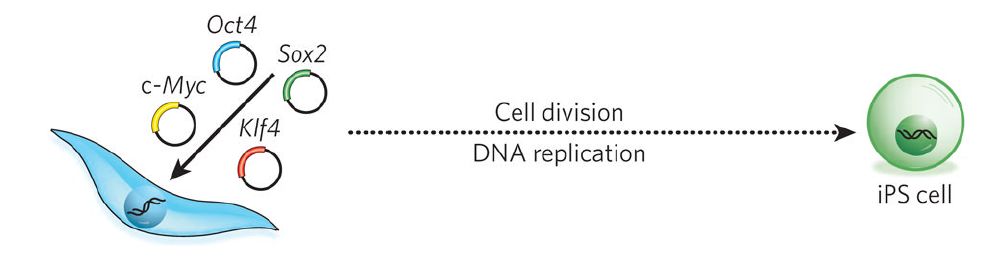 |
Le cellule staminali pluripotenti indotte (iPS) possono derivare da cellule di tessuti differenziati.
Queste cellule vengono riprogrammate grazie all'introduzione di 4 geni noti come Oct4, Sox2, c-Myc e Klf4.
(Ripreso da Yamanaka e Blau, 2010).
|
Il terzo approccio, il trasferimento di fattori di trascrizione, è quello che ha valso il premio Nobel a Yamanaka. Con questo approccio si ottengono cellule
staminali
indotte pluripotenti (iPS cells, induced pluripotent stem cells). Queste cellule hanno proprietà del tutto simili alle cellule staminali embrionali. La
scoperta affascinante fatta da Yamanaka è che queste cellule iPS possono essere ottenute a partire da qualsiasi tipo di cellula adulta differenziata introducendo in essa
quattro geni "magici": Oct4, Sox2, Klf4 and c-Myc. Questi sono fattori di trascrizione che vengono introdotti nelle
cellule adulte utilizzando retrovirus, cioè particolari virus che fanno da vettori di DNA, cioè minuscoli sistemi di trasporto del DNA agli ordini dei biotecnologi.
L'enorme vantaggio delle cellule iPS è che possono essere mantenute in coltura e prodotte in grandi quantità, possono essere originate da cellule adulte del paziente da curare,
eliminando così tutti i problemi etici legati all'utilizzo di cellule embrionali staminali e i problemi clinici dovuti a rigetti da parte del paziente di cellule
non proprie. Queste cellule hanno
dunque potenzialità enormi per le applicazioni cliniche. Infatti, mentre i primi due approcci sono utili per studi di base sulla riprogrammazione cellulare e il
differenziamento, le cellule iPS aprono prospettive impensabili fino a pochi anni fa per la cura di malattie umane, come il Parkinson, l'Alzheimer e molte, molte altre
malattie.
Gli scienziati stanno lavorando per cercare di mettere a punto cellule iPS utilizzabili in medicina. Lasciamoli lavorare in pace, perché è grazie a questo tipo di
studi che potremo vivere meglio e più a lungo.
Referenze
Shinya Yamanaka, Helen M. Blau (2010) Nuclear reprogramming to a pluripotent state by three approaches. Nature, 465: 704-712.
Il laboratorio di Shinya Yamanaka.
La pagina web di John Gurdon.
Manuela Casasoli (manuela_casasoli@yahoo.it)